Es ist so etwas wie eine Reise in das Epizentrum der Krankheit, um direkt darauf einzuwirken. Eine fast unsichtbare Reise von Nanopartikeln, die in der Lage sind, sich selbst im Körper anzutreiben. Nanoroboter sind die Architekten dieser therapeutischen Reise, die sich im Kampf gegen Blasentumore als außerordentlich wirksam erwiesen haben.
Es überrascht nicht, dass es ihnen gelingt, sie um nicht weniger als 90% der Fälle zu reduzieren, so die an Mäusen durchgeführte Forschung, an der das CIC biomaGUNE von Donostia und das Institut für Bioengineering von Katalonien beteiligt sind und die sie an diesem Montag in einer Erklärung angekündigt haben.
Blasenkrebs hat eine der höchsten Inzidenzraten der Welt und ist der vierthäufigste Tumor bei Männern. Trotz der relativ niedrigen Sterblichkeitsrate tritt fast die Hälfte der Blasentumoren innerhalb von 5 Jahren wieder auf und erfordert eine kontinuierliche Überwachung durch die Patienten. Häufige Krankenhausbesuche und die Notwendigkeit wiederholter Behandlungen tragen dazu bei, dass diese Krebsart zu einer der teuersten zu heilenden Krebsarten wird.
Derzeitige Behandlungen, bei denen Medikamente direkt in die Blase verabreicht werden, zeigen zwar gute Überlebensraten, ihre therapeutische Wirksamkeit ist jedoch nach wie vor gering. Eine vielversprechende Alternative ist der Einsatz von Nanopartikeln, die in der Lage sind, therapeutische Wirkstoffe direkt in den Tumor zu bringen. Besonders erwähnenswert sind Nanoroboter – Nanopartikel, die mit der Fähigkeit ausgestattet sind, sich im Körper selbst anzutreiben.
Eine Studie, die in der renommierten Fachzeitschrift Nature Nanotechnology veröffentlicht wurde, zeigt nun, wie es einem Forschungsteam gelungen ist, die Größe von Blasentumoren bei Mäusen durch eine einzige Dosis von Harnstoff-betriebenen Nanorobotern um 90 % zu reduzieren.
Diese winzigen Nanomaschinen bestehen aus einer porösen Kugel aus Kieselsäure. Ihre Oberflächen tragen verschiedene Komponenten mit spezifischen Funktionen. Dazu gehört das Enzym Urease, ein Protein, das mit Harnstoff im Urin reagiert und es dem Nanopartikel ermöglicht, sich selbst anzutreiben. Ein weiterer wichtiger Bestandteil ist radioaktives Jod, ein Radioisotop, das häufig zur lokalen Behandlung von Tumoren eingesetzt wird.
Die Forschung, die vom Institut für Bioengineering von Katalonien (IBEC) und CIC biomaGUNE in Zusammenarbeit mit dem Institut für Forschung in Biomedizin (IRB Barcelona) und der Autonomen Universität Barcelona (UAB) geleitet wird, ebnet den Weg für innovative Behandlungen von Blasenkrebs. Diese Fortschritte zielen darauf ab, die Dauer des Krankenhausaufenthalts zu verkürzen, was zu niedrigeren Kosten und mehr Komfort für die Patienten führt.
“Mit einer einzigen Dosis beobachteten wir eine 90-prozentige Abnahme des Tumorvolumens. Dies ist deutlich effizienter, wenn man bedenkt, dass Patienten mit dieser Art von Tumor in der Regel 6 bis 14 Krankenhaustermine mit aktuellen Behandlungen haben. Ein solcher Behandlungsansatz würde die Effizienz steigern und die Dauer des Krankenhausaufenthalts und die Behandlungskosten reduzieren”, erklärt Samuel Sánchez, ICREA-Forschungsprofessor am IBEC und Leiter der Studie.
Im nächsten Schritt, der bereits läuft, soll festgestellt werden, ob diese Tumore nach der Behandlung wieder auftreten.
Eine fantastische Reise in die Blase
In früheren Untersuchungen bestätigten die Wissenschaftler, dass die Selbstantriebsfähigkeit von Nanorobotern es ihnen ermöglichte, alle Blasenwände zu erreichen. Diese Eigenschaft ist vorteilhaft gegenüber dem derzeitigen Verfahren, bei dem der Patient nach der Verabreichung der Behandlung direkt in die Blase alle halbe Stunde seine Position wechseln muss, um sicherzustellen, dass das Medikament alle Wände erreicht.
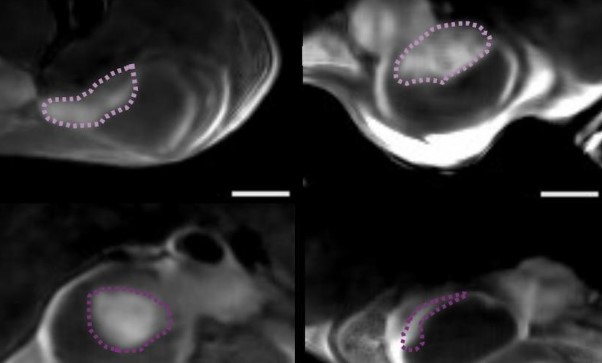
Die neue Studie geht noch einen Schritt weiter, indem sie nicht nur die Mobilität von Nanopartikeln in der Blase, sondern auch ihre spezifische Anreicherung im Tumor nachweist. Möglich wurde dies durch verschiedene Techniken, darunter die medizinische Positronen-Emissions-Tomographie (PET) der Mäuse sowie Mikroskopieaufnahmen des nach Abschluss der Studie entnommenen Gewebes. Letztere wurden mit einem speziell für dieses Projekt am IRB Barcelona entwickelten Fluoreszenzmikroskopiesystem aufgenommen. Das System scannt die verschiedenen Schichten der Blase und liefert eine 3D-Rekonstruktion, die eine Beobachtung des gesamten Organs ermöglicht.
“Das innovative optische System, das wir entwickelt haben, ermöglichte es uns, das vom Tumor selbst reflektierte Licht zu eliminieren, so dass wir Nanopartikel im gesamten Organ ohne vorherige Markierung mit einer noch nie dagewesenen Auflösung identifizieren und lokalisieren konnten. Wir beobachteten, dass die Nanoroboter den Tumor nicht nur erreichten, sondern auch in ihn eindrangen, wodurch die Wirkung des Radiopharmakons verstärkt wurde”, erklärt Julien Colombelli, Leiter der Advanced Digital Microscopy-Plattform am IRB Barcelona.
Zu entschlüsseln, warum Nanoroboter in den Tumor eindringen können, stellte eine Herausforderung dar. Nanorobotern fehlen spezifische Antikörper, um den Tumor zu erkennen, und Tumorgewebe ist in der Regel steifer als gesundes Gewebe.
“Wir haben jedoch beobachtet, dass diese Nanoroboter die extrazelluläre Matrix des Tumors aufbrechen können, indem sie den pH-Wert durch eine selbsttreibende chemische Reaktion lokal erhöhen. Dieses Phänomen begünstigte eine größere Tumorpenetration und war vorteilhaft für die Erzielung einer bevorzugten Akkumulation im Tumor”, erklärt Meritxell Serra-Casablancas, Co-Erstautorin der Studie und IBEC-Forscherin.
So schlossen die Wissenschaftler, dass die Nanoroboter mit dem Urothel kollidieren, als wäre es eine Wand, aber im Tumor, der schwammiger ist, dringen sie in den Tumor ein und reichern sich im Inneren an. Ein Schlüsselfaktor ist die Beweglichkeit der Nanobots, die die Wahrscheinlichkeit erhöht, den Tumor zu erreichen.
Außerdem, so Jordi Llop, Forscher am CIC biomaGUNE und Co-Leiter der Studie, “verringert die lokale Verabreichung der Nanoroboter, die das Radioisotop tragen, die Wahrscheinlichkeit von Nebenwirkungen, und die hohe Anreicherung im Tumorgewebe begünstigt die strahlentherapeutische Wirkung.”
“Die Ergebnisse dieser Studie öffnen die Tür für die Verwendung anderer Radioisotope, die eine größere Fähigkeit haben, therapeutische Wirkungen hervorzurufen, deren Verwendung jedoch bei systemischer Verabreichung eingeschränkt ist”, fügt Cristina Simó, Co-Erstautorin der Studie, hinzu.
Jahrelange Arbeit und ein Spin-off
Die Studie fasst die Ergebnisse der über dreijährigen Zusammenarbeit verschiedener Institutionen zusammen. Ein Teil der Daten stammt aus den Doktorarbeiten von Meritxell Serra und Ana Hortelao, beide Forscherinnen in der von Sánchez geleiteten Gruppe “Intelligente Nano-Bio-Geräte” des IBEC. Es enthält auch die Dissertation von Cristina Simó, Co-Erstautorin der Studie, die ihre Doktorarbeit im Labor für Radiochemie und nukleare Bildgebung unter der Leitung von Jordi Llop am CIC biomaGUNE durchgeführt hat. Die Expertise der Gruppe von Esther Julián an der UAB im Tiermodell der Krankheit ist ein zusätzlicher Beitrag. Darüber hinaus wurde das Projekt vom Europäischen Forschungsrat (ERC) und der Stiftung “la Caixa” gefördert.
Die diesen Nanorobotern zugrunde liegende Technologie, die Samuel Sánchez und sein Team seit über sieben Jahren entwickeln, wurde kürzlich patentiert und dient als Grundlage für Nanobots Therapeutics, ein im Januar 2023 gegründetes Spin-off von IBEC und ICREA.
Das von Sánchez gegründete Unternehmen fungiert als Brücke zwischen Forschung und klinischer Anwendung: “Die Sicherung einer soliden Finanzierung für das Spin-off ist entscheidend, um diese Technologie weiter voranzutreiben und, wenn alles gut geht, auf den Markt und in die Gesellschaft zu bringen. Im Juni, nur 5 Monate nach der Gründung von Nanobots Tx, haben wir die erste Finanzierungsrunde erfolgreich abgeschlossen und blicken begeistert in die Zukunft”, betont Sanchez.
Technologische Innovation in der Mikroskopie zur Ortung von Nanorobotern
Die Arbeit mit Nanorobotern stellt eine bedeutende wissenschaftliche Herausforderung für bioimaging-Verfahren dar, um diese Elemente im Gewebe und im Tumor selbst sichtbar zu machen. Gängige nicht-invasive klinische Techniken, wie z. B. PET, verfügen nicht über die notwendige Auflösung, um diese sehr kleinen Partikel auf mikroskopischer Ebene zu lokalisieren. Daher verwendete die wissenschaftliche Mikroskopieplattform am IRB Barcelona eine Mikroskopietechnik, bei der ein Laserlichtblatt zur Beleuchtung von Proben verwendet wurde, was die Aufnahme von 3D-Bildern durch Lichtstreuung bei Wechselwirkung mit Geweben und Partikeln ermöglichte.
Als die Wissenschaftler beobachteten, dass der Tumor selbst einen Teil des Lichts streute und dadurch Interferenzen erzeugte, entwickelten sie eine neue Technik, die auf polarisiertem Licht basiert und alle Streuungen des Tumorgewebes und der Tumorzellen aufhebt. Diese Innovation ermöglicht die Visualisierung und Ortung von Nanorobotern, ohne dass zuvor mit molekularen Techniken markiert werden muss.
Bild: CIC BIOMAGUNE
Abonniere unseren Newsletter